Die Modellbasierte Pulswellenanalyse (mbPWA)
Neue Wege in der kardiovaskulären Diagnostik
Unser innovatives Diagnoseprinzip der Gefäßuntersuchung gründet auf einem Arterienbaummodell aus den 1960iger Jahren. Wir haben es entscheidend weiterentwickelt und perfektioniert. Das überzeugende Ergebnis: Ein diagnostisches Verfahren, das nicht-invasiv und doch direkt misst — ohne jegliche Umwege.
Mithilfe eines virtuell erzeugten, realistischen Modells des menschlichen arteriellen Gefäßbaums wird der zentrale Blutdruck über peripher erfasste Pulsdruckkurven ermittelt. So präzise, als würde man direkt in die Arterien blicken. Die von uns entwickelte Gefäßdiagnostik bedient sich einer algorithmengestützten Simulation des realen arteriellen Zustands jedes einzelnen Patienten. Dadurch kommt sie vollständig ohne jegliche verfälschende Hilfsparameter aus.
Der entscheidende Unterschied zu bisherigen Untersuchungsansätzen wie der arteriellen Applanationstonometrie: Anstelle eines zugrunde gelegten Populationsdurchschnitts stützen sich unsere Daten auf wirklichkeitsgetreue, individuelle Patientencharakteristika. Dadurch ist es erstmals möglich, Messergebnisse zu erzielen, die 1:1 den aktuellen Zustand innerhalb der Arterien sichtbar machen.
Ein Durchbruch für Diagnostik und Therapie — und dadurch auch eine deutliche Verbesserung der Lebensqualität von Patienten: Mediziner können kardiovaskuläre Endorganschäden viel früher als bisher möglich erkennen und behandeln. Therapeutische Interventionen lassen sich punktgenau nachverfolgen und flexibler als je zuvor anpassen.
Der hämodynamische Hintergrund
Modelle sind ein wichtiges Hilfsmittel, wann immer es darum geht, komplexe Vorgänge zu vereinfachen und zugrundeliegende Mechanismen und Funktionen zu veranschaulichen. Bei der Recherche nach modellhaften Abbildern des arteriellen Systems trifft man auf eine ganze Reihe verschiedener Erklärungsansätze bzw. Konstruktionen.
Der menschliche Blutkreislauf wird zum einen in Röhren- sowie in Verteilungsmodellen nachgebildet, die auf der menschlichen Anatomie basieren. Eine weitere Option stellen vereinfachte Schaltkreismodelle dar. Letztere zeichnen die Blutströmung ebenso wie die Ausbreitung der vom Herzen erzeugten Druckwelle mittels Pulswellen (Strompuls und Druckpuls) nach. Vor diesem Hintergrund kann man den arteriellen Gefäßbaum des Menschen anhand von sogenannten Multikompartiment-Modellen und mithilfe elektrischer Komponenten nachstellen: In Analogie des Blutflusses im Kreislaufsystem und der Fließeigenschaften des elektrischen Stroms verwendet man die Eigenschaften von Widerstandsschaltungen R, Induktionsschaltungen L und Kondensatorschaltungen C (RLC), um physikalische Eigenschaften der Arterien darzustellen.

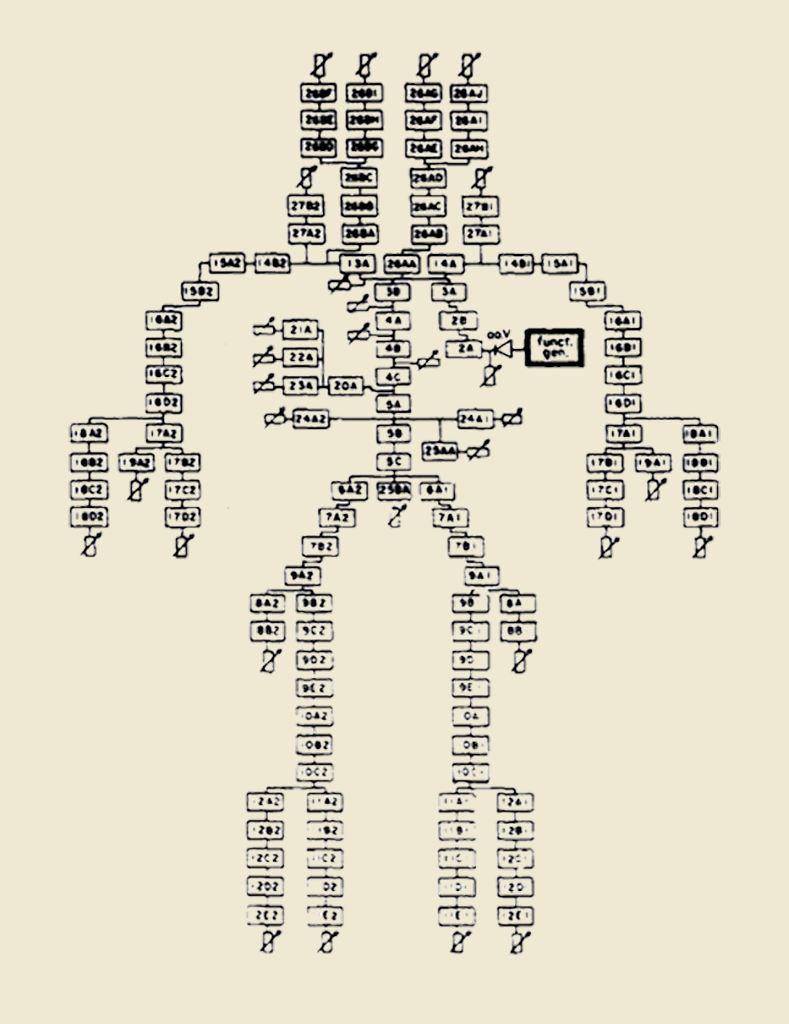
Ein hardwarebasiertes Ur-Modell als Ausgangspunkt der Modellbasierten Pulswellenanalyse
Ein Forscherteam um Abraham Noordergraaf und in der weiteren Überarbeitung Nicolaas Westerhof und Mitarbeiter führten in den 1960er Jahren in den USA erstmals einen hardwaregestützten, handverdrahteten Ansatz zur Modellierung des menschlichen Arteriensystems ein. Früher basierte dies meist auf mathematischen oder physikalischen Modellen. In der finalen Version des Modells wurden insgesamt 113 Hardware-RLC-Schaltungen miteinander verbunden, die die Architektur des Arterienbaums nachbildeten. Jedes Segment repräsentiert etwa 2 bis 8 cm eines Gefäßes. Während seriell geschaltete Widerstände und Induktivitäten den Leitungswiderstand einer Arterie und die viskosen und trägen Eigenschaften des Blutes (longitudinale Impedanz) nachahmen, entsprechen Kondensatoren der Wandcompliance (transversale Impedanz).
Technische Herausforderungen
Die Handhabbarkeit und der mechanische Aufwand bei der manuellen Fertigung eines passiven elektronischen Analogons des menschlichen Arterienbaums stellten in den 1960iger Jahren noch eine echte Herausforderung dar. Daher enthielt die Modellvariante von Noordergraaf ebenso wie die später von Westerhof überarbeitete Version eine ganze Reihe von technischen Zugeständnissen, insbesondere die Zusammenfassung einzelner Windkesselelemente (“lumping” genannt) zu einem einzigen Element. Ursprünglich wurden die arteriellen Eigenschaften (Widerstand, Compliance und Blutmassenträgheit) für 1‑cm-Arteriensegmente bestimmt, was zu mehr als 700 Windkessel-Elementen für das Modell geführt hätte.
Die ursprüngliche Berechnungsgrundlage
Noordergraafs Lösung bestand darin, den ungeheuren manuellen Aufwand, der mit 700 Windkessel-Elementen einhergegangen wäre, radikal zu begrenzen. Er reduzierte ihre Anzahl in der Endversion auf etwa 100 Elemente, die in Hardware zu bauen waren. Die Beziehung zwischen den pauschalen R‑, L- und C‑Werten für jede pauschale Größe Δx im Vergleich zu den R’, L’ und C’, die für die Größe von 1 cm berechnet wurden, beschreibt Noordergraaf mithilfe der folgenden Formel:
L = L’ Δx, R = R’ Δx, C = C’ Δx
Die Problematik der reduzierten Komplexität
Die somit verringerte Komplexität im Hinblick auf den Modellaufbau ging indessen mit einer verfälschten Wiedergabe der natürlichen Strömungseigenschaften einher: Die Kopplung von Windkesseleinheiten ignorierte die tatsächlichen Resonanzeigenschaften der arteriellen Segmente und deren Bedeutung für die Durchlässigkeit der Pulswelle. Noordergraaf wusste zwar, dass die Höhe der Resonanzspitzen verzerrt war. Er maß dieser Tatsache aber keine große Bedeutung bei, vermutlich wegen des Fehlens unserer modernen Simulationswerkzeuge. Westerhof übernahm Noordergraafs sogenannte Klumpenformeln später in sein verbessertes Modell.
Unsere Weiterentwicklung: Das virtuell verfeinerte Westerhof-Modell
Durch den Einsatz modernster Software-Simulationswerkzeuge waren wir zum einen in der Lage, das von Noordergraaf erstellte und später von Westerhof und Mitarbeitern überarbeitete Modell originalgetreu zu reproduzieren. Im Laufe unzähliger Testdurchläufe simulierten wir verschiedenste, typische Arterienzustände. So gewannen wir wichtige Erkenntnisse zum Verständnis und zur Verbesserung seines Verhaltens.
Bei der anschließenden Korrektur und Verfeinerung des Modells legten wir im Gegensatz zu Westerhof und Noordergraf besonderen Wert auf die Erhaltung der nach unserer Überzeugung essentiell wichtigen Resonanzfrequenzen: Diese blieben auch im neuen Modell innerhalb der einzelnen 1cm-Arterienabschnitte erhalten.
So gelang es uns am Ende, die technologischen Einschränkungen des Noordergraaf-Westerhof-Modells komplett aufzuheben. In der Folge verbesserte sich die Gesamtmodellqualität erheblich: Während das von Westerhof weiterentwickelte Modell am Ende aus 121 Windkessel-Elementen bestand, verfügt das von uns verfeinerte Modell über 711 Elemente. Dadurch liefert unsere Arterienbaumsimulation realistische Pulswellenformen der Aorta und der brachialen und radialen Arterien. Gleiches gilt für die realistische Wiedergabe von Blutdrücken.
Der Vorher-Nachher-Effekt: Vom Noordergraaf/Westerhof-Modell zum Gefäß-Avatar

Multiple gekoppelte Resonanzen statt reflektierter Welle
Das neue Arterienbaummodell erbrachte neue Erkenntnisse im Hinblick auf die Entstehung der physiologischen, aortal-radialen Übertragungsfunktion: Nach unserer Überzeugung ist sie auf die Kopplung vieler kleiner Resonanzelemente innerhalb eines komplexen Arterienbaums zurückzuführen.
Diese völlig neue Einsicht kann der gängigen (allerdings ohnehin nicht unumstrittenen) Lehrmeinung, die den sekundären systolischen Peak auf eine arterielle Druckwellenreflexion zurückführt, wichtige neue Impulse geben. Unsere Hypothese der multiplen gekoppelten Resonanzen innerhalb des arteriellen Systems wird auch durch die Tatsache untermauert, dass das von uns überarbeitete, verfeinerte Modell keine völlige Neuschöpfung darstellt. Die Endversion unseres Modells korrigierte nur einige Vereinfachungen im ursprünglichen Westerhof-Modell, die zu viel zu niedrigen Resonanzfrequenzen geführt hatten.
Wie unsere Experimente mit dem verfeinerten Modell zeigen, entwickelt sich die aortal-radiale Übertragungsfunktion entlang des Weges von der aufsteigenden Aorta zur radialen Arterie. In gleicher Weise entstehen auch die sekundären systolischen Wellen nicht an bestimmten distalen Stellen, sondern entwickeln sich auf dem gesamten Weg von der aufsteigenden Aorta bis zu der Stelle, an der sie gemessen werden. Nach unserem Wissen ist dies das erste Mal, dass die Bildung der bekannten, aortal-radialen Übertragungsfunktion in einem individualisierten Arterienbaummodell erklärt und demonstriert werden kann.

Die Physiologie des dynamischen Blutflusses bei Karotisstenose
Ein reales Abbild der Arterien
Um zu verstehen, worin die Neuartigkeit des von uns überarbeiteten, verfeinerten Modells liegt, muss man sich folgendes vergegenwärtigen: Das ursprüngliche Noordergraaf/Westerhof-Modell aus den 1960iger Jahren gab das Arteriensystem eines 26-Jährigen wieder. Es war somit ein reines Anschauungs- und Studienobjekt. Das von uns mittels moderner Software-Tools perfektionierte Modell ist jedoch gerade kein idealisiertes Modell eines beliebigen Menschen. Ganz im Gegensatz zu einem bloßen Anschauungsmodell ist das neue Modell an den Arterienbaum jedes realen Menschen adaptierbar.
Es handelt sich um einen durchaus revolutionär zu nennenden, neuen Ansatz, der folgerichtig mit einer ebenso innovativen Messmethode einhergeht. Wie zuvor beschrieben lag der Focus bei der Entwicklung der neuen Messmethode zunächst darauf, realistische Pulskurvenformen zu generieren. Nachdem dies gelungen war, lag der klinische Nutzen des neuen Modells unmittelbar auf der Hand: Denn nun ist das künstliche arterielle System des Arterienbaummodells an einen realen Patienten anpassbar. Dadurch leistet das neugeschaffene Modell auf vielfältigste Weise wertvolle Unterstützung in der kardiovaskulären Diagnostik und Prävention. Der Clou: Was man real ohne invasive Maßnahmen (bspw. risikoreiche Herzkathederuntersuchungen) gar nicht messen könnte, ist nun problemlos in simulatione, also am Abbild des lebenden Menschen — im Gefäßavatar — ablesbar.
Abnormale oder kranke Gefäßzustände können sich hierbei beispielsweise durch erhöhte Leitungswiderstände R (z.B. Stenose, Thrombose, Gefäßtonusdysfunktion), erhöhte Trägheitseigenschaften des Blutes L (z.B. hoher Hämatokrit) oder geringe arterielle Compliance C (z.B. steife oder entzündete Arterien aufgrund von Arteriosklerose oder Atherosklerose) manifestieren. Die individuellen Multiplikatoren dMult, lMult und cMult stimmen dabei offenbar sehr gut mit dem spezifischen arteriellen Gesundheitszustand einer Person überein.
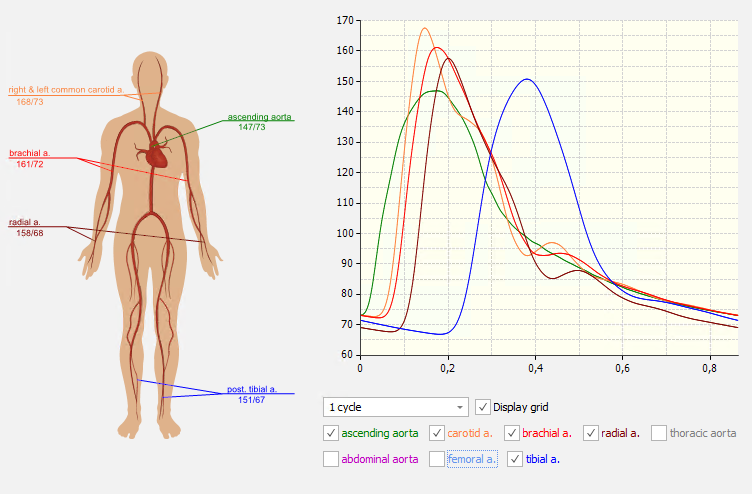
Die Auswertung einer Messung mit der Modellbasierten Pulswellenanalyse
Klinische Anwendungsbereiche
Unsere Einsichten im Hinblick auf die resonante Natur der aortal-radialen Übertragungsfunktion eignen sich sowohl für Forschungs- als auch für Ausbildungszwecke. Die aus unserem verfeinerten Modell abgeleitete, individualisierte Übertragungsfunktion berücksichtigt unterschiedliche Patientencharakteristika. Auch lässt sie sich zur Ermittlung zentraler Blutdruckwerte verwenden.

Zentral vs. brachial: Medikamenteneffekte sichtbar machen, Therapien anpassen
Nicht-invasive Messungen des zentralen Blutdrucks sind im klinischen Kontext von hohem Nutzen. Besondere Relevanz erlangen unsere Erkenntnisse bei der Behandlung von Bluthochdruckpatienten: Überprüft man ihre zentralen Werte, lassen sich wichtige Unterschiede in der Wirkweise zwischen verschiedenen Klassen von Antihypertensiva nachweisen. Oft wird beispielsweise die blutdrucksenkende Wirkung von Betablockern überschätzt. Dies lässt sich möglicherweise durch Veränderungen der arteriellen Eigenschaften erklären, die durch die Bradykardie verursacht werden und den zentralen systolischen Druck sowie den Pulsdruck erhöhen. Weitere mechanistische Untersuchungen stehen in diesem Zusammenhang zwar noch aus. Unser individualisiertes Arterienbaummodell verfügt hierbei in jedem Fall über vielversprechendes Potential, für die softwarebasierte Untersuchung verschiedenster Medikamenteneffekte in Zukunft von großem Nutzen zu sein.
Auch abseits von Betablockern gilt: Man kann jegliche medikamentöse Hypertonie-Therapie durch Rückgriff auf die zentralen, signifikant aussagekräftigeren Blutdruckwerte besser auf individuelle Bedürfnisse und mögliche Komorbiditäten von Patienten abstimmen, als dies mit rein brachial gemessenen Daten möglich wäre. Durch wiederholte Kontrollmessungen können Ärzte im Verlauf der Behandlung sicherstellen, dass erwünschte therapeutische Effekte tatsächlich eintreten — bei rein pharmakologischer Intervention etwa durch Wirkstoffklassenwechsel, Dosiserhöhung bzw. ‑reduktion oder durch eine Kombinationstherapie. Messungen des aortalen Blutdrucks geben zudem Aufschluss darüber, ob Patienten in einem frühen Stadium von Herzkreislaufbeeinträchtigungen eine bestehende Medikation nach Absprache mit dem Arzt rein durch wirkungsvolle Lebensstiländerungen mindestens verringern oder sogar nach einiger Zeit ganz absetzen können. Manchmal ist es auch bei Einhaltung eines gesundheitsfördernden Lebensstils möglich, lange Zeit ganz auf die Einnahme eines Antihypertonikums zu verzichten. Die Daten des zentralen Blutdrucks (in regelmäßigen Abständen erhoben) sind hierbei von entscheidender Bedeutung, da sie im Gegensatz zu brachial erhobenen Messwerten den tatsächlichen Zustand des Herzens widerspiegeln.
Hämodynamische Parameter und biologisches Gefäßalter

Die invasive Bestimmung zentraler hämodynamischer Parameter zeigte eine Assoziation zwischen Flexionszeit und Augmentationsindex der aufsteigenden Aorta und dem Risiko einer koronaren Herzerkrankung bei symptomatischen Risikopatienten. Diese Befunde ließen sich nicht-invasiv mittels Applanationstonometrie bestätigen.
Allerdings stellen diese konventionellen Parameter eher indirekte Indikatoren für die arteriellen Eigenschaften dar. Wir postulieren, dass die im verfeinerten Modell verwendeten Anpassungsfaktoren direkt dem gesamten arteriellen Leitungswiderstand (dMult), der Blutträgheit (lMult) und der Arterienwandcompliance (cMult) eines individuellen Patienten entsprechen. Sie können verschiedene Gesundheitszustände repräsentieren und sind daher für die Abschätzung des biologischen Gefäßalters nützlich.
Ein Frühwarnsystem für Schädigungen des Endothels

Die Fähigkeit, den Gefäßtonus zu kontrollieren, wird durch das Altern und durch eine endotheliale Dysfunktion beeinträchtigt. Dies führt zu Hypertonie und Atherosklerose. Wir gehen davon aus, dass eine solche Dysbalance des Gefäßtonus’ auch im Ruhezustand vorhanden ist. Darauf wiederum fußt unsere Hypothese, dass ein mit dem verfeinerten Modell nachgewiesener, erhöhter Leitungswiderstand ein Frühindikator für eine Dysbalance des Endothels und Atherosklerose sein könnte. Diese Arbeitshypothese sollte in einer klinischen Studie validiert werden, z. B. durch Messung der flussvermittelten Dilatation (FMD) als anerkanntem Goldstandard.
Darüber hinaus empfehlen wir weitere Untersuchungen, um das Potenzial des künstlichen Arterienmodells für die Risikovorhersage zu bewerten. Unter anderem ließe sich damit die invasive Beurteilung von Patienten mit einem Risiko für eine vorzeitige koronare Herzkrankheit anleiten.