Unsere Arterien spielen für unsere Gesundheit eine ganz wesentliche Rolle. Sie übernehmen nicht nur die Versorgung der Organe mit sauerstoffreichem Blut, sondern gewährleisten durch ihre ganz besonderen Wandeigenschaften, dass der Bluttransport möglichst energiesparend, schonend und gleichmäßig vonstatten geht. Und dass auch der entfernteste Bereich des Körpers nicht vernachlässigt wird, sowohl im Liegen als auch im Stehen. Nicht umsonst lautet ein populärer Ausspruch: “Der Mensch ist so alt wie seine Gefäße”.
Das VascModel
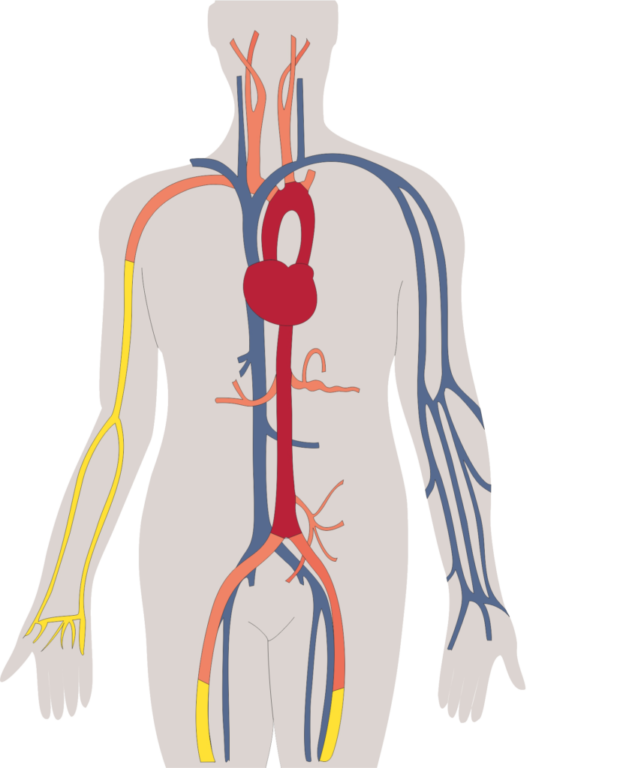
Direkte vs. indirekte Bestimmung der Arterieneigenschaften
Die Wandeigenschaften der Arterien lassen sich beim lebenden Menschen nicht direkt bestimmen. Eine Biopsie eines kompletten Arterienwandsegments ist im Normalfall nicht möglich und auch die visuelle Darstellung von Arteriensegmenten wie z.B. bei der Intima-Media-Dickenbestimmung leidet darunter, dass zwar die Gefäßqualität eines einzelnen, kurzen Segments mit hoher Qualität darstellbar ist. Aber die Funktionsweise eines ganzen Arterienbaums, nämlich das Blut energieeffizient und gleichmäßig zu den Organen zu transportieren, und die Bestimmung seiner physikalischen Eigenschaften im Ganzen können so nicht ermittelt werden. Somit bleiben für die Funktionsbeurteilung der Arterien im Wesentlichen indirekte Messverfahren wie z.B. die Pulswellengeschwindigkeit oder der Augmentationsindex, mit deren Hilfe auf die Arterieneigenschaften geschlossen werden kann.
Technische Simulationsmodelle
Das Problem, dass physikalische Parameter von Untersuchungsobjekten nicht oder nur mit immensem Aufwand direkt bestimmt werden können, tritt in Forschung und Entwicklung recht oft auf, zum Beispiel bei der Bestimmung von Strömungseigenschaften bei Prototypen von Flugzeugen oder Schiffen. Und immer wieder greift man hier wie dort auf ein bewährtes Mittel zu: Das Simulationsmodell. Gelingt es, ein möglichst reales Modell des Untersuchungsobjekts zu erstellen, lassen sich hiermit viele Untersuchungen wesentlich vereinfachen oder sogar erst ermöglichen.
Lässt sich ein menschlicher Arterienbaum im Modell simulieren?
Und so stellten wir uns zu Beginn unseres Projekts die Frage: Ist es möglich, ein Modell des Arterienbaums eines beliebigen Menschen anzufertigen? Und kann man darin tatsächlich die Arterieneigenschaften quasi “direkt” messen? Sozusagen “in simulatione” statt “in vivo” …
Das Noordergraf-Westerhof-Modell von 1969
Unser Projekt zur Entwicklung eines individualisierbaren Arterienmodells starteten wir mit einer Recherche nach schon veröffentlichten Arterienmodellen. Sehr viele Modelle basieren auf der Analogie zwischen dem elektrischen Stromkreislauf und dem Blutkreislauf, andere auf rein mathematischen Modellen. Eines der bekanntesten und meistzitierten Modelle wird in der Veröffentlichung von Noordergraf und Westerhof [1] aus dem Jahr 1969 beschrieben. Da es sehr gut dokumentiert und nachvollziehbar ist, entschieden wir, dieses elektrische Modell zur Grundlage für unsere Untersuchungen zu machen.
Re-engineering mit moderner Technologie
Noordergraf und Westerhof bauten ihr Arterienmodell mit realen elektronischen Komponenten auf und verdrahteten es von Hand — ein immenser Aufwand für ein statisches und nicht leicht veränderbares Modell. Hierzu verwendeten sie 121 Baugruppen, die die teils sehr unterschiedlichen Segmente (“Windkesselelemente”) des gesamten Arterienbaums nachbilden sollten. Heutzutage sind wir in der Lage, elektronische Schaltkreise per Software zu realisieren und ihr Verhalten mit hoher Präzision zu simulieren und zu parametrisieren und so konnten wir mit Hilfe der Software LTspice das Noordergraf-Westerhof-Modell gut nachbilden und diversen Tests unterziehen. Dabei stellten wir bald fest, dass das Modell in einigen wesentlichen Aspekten stark von der physiologischen Realität abwich. Im Modell wurden nämlich — um den Aufwand für den manuellen Aufbau in Grenzen zu halten — Vereinfachungen vorgenommen, die die tatsächlich vorhandenen Resonanzeigenschaften der Arterien ignorierten. Wir konnten diese Vereinfachungen im Software-Modell rückgängig machen und nahmen einige weitere Korrekturen vor. Unser verfeinertes Modell besteht in der Folge aus 711 statt 121 Windkesselelementen.
Die Entwicklung des verfeinerten Softwaremodell haben wir zusammen mit Wissenschaftlern der Universität Heidelberg-Mannheim Anfang 2018 im Journal of Applied Physiology veröffentlicht [2]. In dieser Publikation sind auch erstmals einige wichtige neue Perspektiven in Bezug auf das dynamische Verhalten der Arterien und die Entstehung der unterschiedlichen Pulswellenformen enthalten. Für das tiefere Verständnis des neuen Arterienmodells und die Schlussfolgerungen daraus empfehlen wir Lektüre der Veröffentlichung (open access).
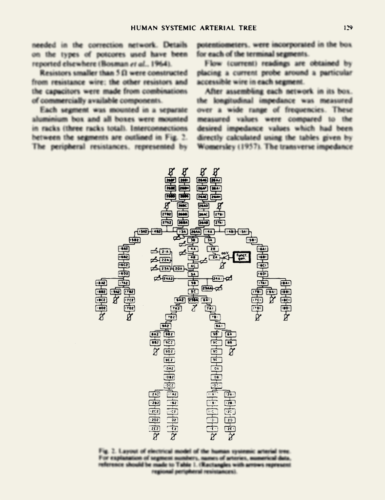

Wo ist der klinische Nutzen?
Das verfeinerte Arterienmodell verhielt sich nach Einführung unserer Korrekturen schon sehr realistisch. Es war schon möglich, bekannte Pulskurvenformen im gesamten Arterienmodell zu erzeugen, wobei als “künstliches Herz” im Wesentlichen nur ein per Software justierbarer, vereinfachter Dreiecksimpuls fungierte — entsprechend dem Verlauf des Blutauswurfs aus dem realen Herzen.
Damit konnte das Arterienmodell schon sehr gut zu Anschauungszwecken genutzt werden. Man konnte — ähnlich wie es Noordergraf und Westerhof in ihrer Originalveröffentlichung taten — die Gefäße auf eng oder weit, steif oder elastisch und den peripheren Widerstand auf hoch oder niedrig stellen und die Veränderungen in den Pulswellenformen an den unterschiedlichsten Stellen im Arterienmodell beobachten.
Doch der klinische Nutzen solcher Modelle ist derzeit immer noch sehr gering, wie folgendes Zitat treffend beschreibt:
Gerade komplexere (…) kardiovaskuläre Modelle wurden meist zu Forschungszwecken entwickelt. Bis heute werden nur die Konzepte der vaskulären Impedanz und der Pulswellengeschwindigkeit im größeren Umfang genutzt, um bei klinischen Diagnosen und Behandlungen zu unterstützen und nur wenige (…) integrierte Modelle, die Herz und Gefäße als Ganzes abbilden, sind in der klinischen Praxis zu finden. Mit dem Erfolg von (…) Modellen bei der Simulation kardiovaskulärer Dynamiken unter verschiedenen physiologischen und pathologischen Bedingungen (…) wird es Zeit, zusammen mit den klinischen Anwendern die integrierten Modelle zu personalisieren, um ein patientenspezifisches Modelling zu erreichen, was dann Innovationen für die kardiovaskuläre Praxis hervorbringen wird [3].
Identifikation der Modellparameter
Wir kommen auf unsere obige Frage zurück: Ist es möglich, ein Modell des Arterienbaums eines beliebigen Menschen anzufertigen? Und können wir darin dann wichtige arterielle Kreislaufeigenschaften “in simulatione” ablesen?
Um ein individualisiertes Arterienmodell zu berechnen, muss man zunächst die wichtigsten Modellparameter identifizieren, die ausreichen, um mehr oder weniger alle vorkommenden Pulskurvenformen zu simulieren. Dies ist bei allen Modellen der wichtigste Schritt, um Simulationen effektiv und qualitativ durchführen zu können. Ist die Anzahl der Modellparameter zu hoch, strebt die Simulationsdauer gegen Unendlich, ist die Anzahl zu niedrig, sinkt die Qualität der Simulation. Die acht Parameter wurden im Rahmen unserer Forschungsarbeiten innerhalb von ca. zwei Jahren ermittelt und sind eine ausgefeilte Kompromisslösung, die einerseits eine vernünftige Simulationsdauer, andererseits eine hinreichende Simulationsqualität gewährleisten.
Es handelt sich dabei zum einen um die physikalischen Arterieneigenschaften (die zentralen Elemente des arteriellen Windkessels eines Arterienabschnitts):
- Zentrale Gefäßelastizität bzw. Gefäßsteifigkeit, stellvertretend für die Elastizität bzw. Steifigkeit aller großen elastischen Arterien,
- Periphere Gefäßelastizität bzw. Gefäßsteifigkeit, stellvertretend für die Elastizität bzw. Steifigkeit aller muskulösen Leitungsarterien,
- Flusswiderstand der Arterien, stellvertretend für den Widerstand, den das Blut beim Passieren der Arterien erfährt und
- Blutmassenträgheit, stellvertretend für die Fließeigenschaften des Blutes.
Zum anderen muss der dreiecksförmige Blutflussimpuls, der beim Auswurf des Bluts aus der linken Herzkammer entsteht, mit Hilfe folgender Parameter angepasst werden:
- Dauer des maximalen Blutflusses LVPT (left ventricular plateau time, wenn diese nicht Null ist, wandelt sich der Dreiecksimpuls zu einem Trapez) — Strecke 1 im Diagramm rechts
- Linksventrikuläre Auswurfzeit LVET (left ventricular ejection time) — Strecke 2 im Diagramm
- Zyklusdauer — Strecke 3 im Diagramm
- Amplitude des Rückflusses nach Herzklappenschluss — Strecke 4 im Diagram
Wie man leicht erkennt, sind die Modellparameter genau die wichtigen Parameter, die letztendlich die arteriellen Kreislaufeigenschaften beschreiben und von denen uns die meisten für die klinische Anwendung interessieren. Gelingt die Modellierung so, dass das Modell die Pulskurven eines beliebigen Probanden erzeugen kann, haben wir mit den Modellparametern gleichzeitig die Eigenschaften von Herz und arteriellem Kreislauf des Probanden ermittelt — und dies nicht nur punktuell, sondern als Systemparameter, der etwa die durchschnittliche Steifigkeit oder auch die Durchlässigkeit der Leitungsarterien des ganzen Arterienbaums oder zumindest eines ganzen Abschnitts (bspw. vom Herzen bis zur A. radialis) widerspiegelt.

Anpassungsparameter des Blutflussimpulses
1: LVPT (Left ventricular plateau time)
2: LVET (Left ventricular ejection time)
3: Zyklusdauer
4: Amplitude des Rückflusses
Der entscheidende Schritt: Automatisierte Berechnung des individuellen Arterienmodells
Nachdem die Modellparameter gefunden waren, mussten wir eine Rechenvorschrift (Algorithmus) entwickeln, der die Modellparameter so anpasst, dass sich ein reales Abbild des arteriellen Kreislaufsystems einer beliebigen Person ergibt. Eine einfache Methode wäre, alle Kombinationsmöglichkeiten der acht Modellparameter mit einer vernünftigen Rechengenauigkeit zu simulieren und die jeweils erzeugten Radialispulskurven mit den gemessenen Radialispulskurven zu vergleichen. Diejenigen Modellparameter, deren simulierte Pulskurve die höchste Übereinstimmung mit der gemessenen Pulskurve eines Probanden ergäbe, wären die gesuchten, individualisierten Modellparameter.
Leider ist diese Methode nicht anwendbar, da sich selbst bei der geringen Anzahl von acht Modellparametern und bei einer Simulationsdauer von etwa 1 bis 3 Sekunden aufgrund der hohen Anzahl von Kombinationsmöglichkeiten eine Rechenzeit ergäbe, die länger wäre als die Zeit vom Urknall bis heute …
Nach etlichen, zum Teil sehr aufwändigen Versuchen konnten wir ein dreistufiges Berechnungssystem entwickeln, das — vereinfacht dargelegt — folgendermaßen arbeitet:
-
- Eine künstliche Intelligenz in Form eines trainierten Neuronalen Netzwerks schätzt anhand von gemessenen Pulskurve der A. radialis alle acht Modellparameter ab. Hierzu werden im Standardfall mit Hilfe des Messgerätes “VascAssist 2” an der linken und an der rechten A. radialis abwechselnd 15 Pulszyklen aufgezeichnet und dies insgesamt drei Mal. Die Pulszyklus-Sequenzen werden von Artefakten bereinigt und mittels Signal Averaging zu insgesamt sechs repräsentativen Einzelzyklen gemittelt. Alle sechs Einzelzyklen werden hintereinander dem Neuronalen Netzwerk zugeführt, die sechs abgeschätzten Modellparametersätze werden zu einem mittleren Parametersatz gemittelt. Dieser erste Schritt dauert nur wenige Sekunden.
- Der Modellparametersatz, der eine erste Schätzung darstellt, ist die Grundlage für die zweite Stufe des Berechnungssystem. Mittels eines sogenannten “evolutionären Algorithmus” werden die acht Parameter so lange variiert bzw. optimiert, bis sich ein stabiler Endzustand für die Modellparameter einstellt. “Evolutionäre Algorithmen” sind sehr gut tauglich für Problemlösungen, bei denen eine Anzahl Eingangsdaten (unsere acht noch nicht so perfekten Modellparameter) variiert werden können und für jeden Variationsschritt die Güte des Zwischenergebnisses (evolutionäre Fitness) berechnet werden kann. In unserem Fall wird die Güte jeder Variation dadurch berechnet, dass die variierten Modellparameter ins Arterienmodell eingesetzt werden, eine Simulation durchgeführt wird und anschließend die ermittelte Kurve an der künstlichen A. radialis mit den gemessenen repräsentativen Einzelzyklen verglichen wird. Die Höhe der Übereinstimmung von künstlichem Arterienpuls mit gemessenem Arterienpuls ist dann die Güte der Variation, ihre “Fitness”. Dieser zweite Schritt dauert je nach Rechnerausstattung zwischen 10 und 40 Minuten.
- Bei den bisherigen Schritten wurde nur die normierte Kurvenform der simulierten Pulswelle mit der normierten Form der gemessenen Pulswelle zur Übereinstimmung gebracht, dadurch wurden die Windkesselelemente der elastischen Arterien und der Leitungsarterien festgelegt. Im letzten Schritt werden nun der periphere Widerstand, der durch die kleinen Arterien und Arteriolen entsteht sowie die Absolutamplitude des Blutflussimpulses aus dem Herzen so lange variiert, bis der Brachialdruck in der Simulation mit dem zuvor gemessenen Brachialdruck des Probanden übereinstimmt. Dadurch nehmen die Absolutdrücke im System realistische Werte an und es kann sogar der absolute Zentraldruck direkt am Eingang zur Aorta in der Simulation “gemessen” werden. Dieser Schritt beansprucht einige Sekunden.
Am Ende der dritten Berechnungsstufe stehen dann der optimierte Modellparametersatz und die Simulationsqualität in Prozent zur Verfügung. Die Qualität erreicht in schlecht simulierbaren Fällen eine Genauigkeit von 97%, häufig 99,5%, aber durchaus auch 99,9%. Ein Wert von 100% würde eine vollkommene Übereinstimmung von Simulation und Realität bedeuten.
Beispiel-Berechnung des Arterienmodells eines 65-Jährigen
Und letztendlich: Der klinische Nutzen des neuen Arterienmodells “VascModel”
Im Lauf der Zeit zeichnete sich ab, dass die für jede Person ermittelten Modellparametersätze eine ganze Fülle von klinisch wertvollen Informationen liefern.
Etliche bekannte Parameter wie z.B. die Gefäßsteifigkeit erfahren bei der Ermittlung über das individualisierte Modell eine ganz neue Qualität und Plausibilität im Vergleich zur indirekt über Pulswellengeschwindigkeit und Augmentationsindex ermittelten Steifigkeit.
Auch der zentrale Blutdruck lässt sich im Modell mit neuer Qualität ablesen, die Veröffentlichung einer klinischen Validierung steht derzeit kurz bevor.
Der weitaus interessanteste Parameter, der nicht immer Hand in Hand geht mit der Gefäßsteifigkeit, ist jedoch der arterielle Durchflusswiderstand, der zwar bekannt, aber unserer Meinung nach vollkommen unterschätzt wird. Er ist einerseits mit herkömmlichen Mitteln kaum direkt noch indirekt messbar, im Modell ist er aber sehr leicht und gut reproduzierbar zu ermitteln. Letztendlich dürfte er insgesamt sogar bedeutungsvoller sein als die Gefäßsteifigkeit, zeigt er doch auf leicht verständliche Art und Weise an, wie “durchgängig” die wichtigen Leitungsarterien sind. Beeinflusst wird der Leitungswiderstand zum einen durch das mittlere freie Lumen der Gefäße. Liegen auf einem Arteriensegment Ablagerungen, Plaque oder sogar Engstellen, erhöht sich der Widerstand dramatisch. Und ist zum anderen die Variation des Gefäßtonus, also die Weit- oder Engstellung der Gefäße, aufgrund von Atherosklerose und der einhergehenden Endothel-Dysfunktion eingeschränkt, ist der Widerstand auch im Ruhezustand deutlich erhöht. Da die Ablagerung von Plaque in den Gefäßen und die Atherosklerose häufig vergesellschaftet sind, steigt bei entsprechendem Gefäßstatus der Widerstand doppelt stark an und ist leicht erkennbar. Da Veränderungen des inneren Durchmessers der Arterien in vierter Potenz (!) in den Widerstand eingehen, lässt sich die Zunahme des Widerstands in einigen Fällen schon im Alter von 20–30 Jahren feststellen (beispielsweise bei Adipositas). Dies erfolgt dann in einem Stadium, das noch keine klinische Relevanz besitzt, wo aber die Früherkennung in Verbindung mit einer adäquaten Intervention (sportliche Betätigung, Ernährungsumstellung, …) zu einer anerkannt deutlichen Steigerung der Lebenserwartung führen kann.
An dieser Stelle würde eine weiterführende Darstellung aller neuen Möglichkeiten des individuellen Arterienmodells den Rahmen sprengen. An anderer Stelle gehen wir jedoch auch auf weitere Parameter und Auswertungsdetails ein, beispielsweise auch auf die Plateauzeit des Blutfluss-Impulses, der unserer Vermutung nach Schlüsse auf Herzvitien zulässt (siehe … !!!).
Quellen:
- Westerhof N, Bosman F, De Vries CJ, Noordergraaf A. Analog studies of the human systemic arterial tree. J Biomech 2: 121–143, 1969. doi:10. 1016/0021–9290(69)90024–4.
- Shi Y, Lawford P, Hose R. Review of Zero‑D and 1‑D Models of Blood Flow in the Cardiovascular System. Biomedical Engineering OnLine 2011, 10:33.